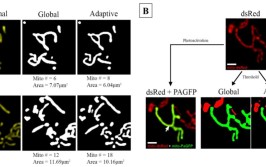
做细胞研究,怎么能不会线粒体?线粒体(Mitochondrion)是一种存在于大多数细胞中的由两层膜包被的细胞器,是细胞中制造能量的结构,是细胞进行有氧呼吸的主要场所活细胞中线粒体存在融合和裂变的动态循环稳态,研究表明,融合和裂变的平衡直接影响线粒体网络形态并由此影响ATP稳态和细胞功能,在细胞的生理和病理过程中扮演了十分重要的角色目前最常见的线粒体形态检测方法包括电镜法和共聚焦显微镜法,电镜只能获取静态图像,而共聚焦显微镜由于其优秀的动态检测能力,在线粒体网络研究中得到了更广泛的应用那么如何对线粒体进行形态学分析?目前大部分线粒体分析软件均为商用软件,已有的免费软件很难分析比较厚的细胞或存在密集线粒体网络的细胞(如胰岛β细胞)今天半夏给大家分享基于美国NIH开发的ImageJ软件进行线粒体形态学分析ImageJ(https://imagej.nih.gov/ij/)是美国NIH开发的免费开源图像处理软件,广泛的应用于生物、医学领域Fiji是已经预装了诸多生物医学分析的常用插件的ImageJ,其下载链接为:https://imagej.net/Fiji/DownloadsMitochondria Analyzer分析线粒体网络Mitochondria Analyzer插件将3D ImageJ Suite、ImageScience、IJPB-Plugins(MorphoLibJ)等插件联用,可以实现复杂线粒体网络的2D、2D时间序列(xyt),3D和4D(xyzt)图像分析;同时还支持多通道的同时分析【1】1. Mitochondria Analyzer插件安装方法Mitochondria Analyzer要求ImageJ 1.52版本或以上,且只能在Windows中运行,目前没有Mac OS版本可以通过以下方式安装Mitochondria Analyzer及所有分析所需插件:ImageJ主界面 -> help -> Update,打开ImageJ Updater主界面,点击Manage Update Sites:勾选以下站点:a. 3D ImageJ Suite;b. ImageScience ;c. IJPB-Plugins点击Add Update Site,在Name中输入Mitochondria Analyzer,在URL中输入http://sites.imagej.net/ACMito/,依次点击Close -> Apply Changes:重启ImageJ/FiJi,检查下载的文件是否在Update文件夹中,如果在,将其转移到Plugins文件夹中,完成安装2. Mitochondria Analyzer分析流程Mitochondria Analyzer 2D和3D线粒体分析的总体流程如下:3. 线粒体图像获取高质量的图像采集对于Mitochondria Analyzer线粒体网络的精确分析很重要,对于3D图像,最好采用最佳奈奎斯特采样率(https://svi.nl/NyquistCalculator)进行采样并通过相关软件去卷积(deconvolved),这将有助于提高3D重建和分析的准确性去卷积软件包括Huygens Professional、ImageJ/Fiji插件DeconvolutionLab2等3D图像栈可以通过“3D Viewer” or “Volume Viewer”进行查看4. 图像处理① 线粒体形态分析之前需要对图像进行预处理,并设定合适的阈值,以将图像中的线粒体与背景区分开并精确的识别出来;此外,如果为叠加多通道图像,需拆分单通道,Image -> Color -> Split Channels,并将单通道图像转化为8-bit格式此外还需要将像素单位改为微米Image -> Properties② 在ImageJ/FiJi主菜单中点击Plugins -> Mitochondria Analyzer -> Analyzer manager,打开Mitochondria Analyzer的操作主界面:③ 点击进入2D Threshold Optimize,可以看到阈值设定和图像处理过程包含以下步骤:预处理、阈值优化、后处理预处理包括“Subtract Background”,“Sigma Filter Plus”,“Enhance Local Contrast”和“Gamma Correction”后处理包括“Despeckle”,“Remove Outliers”与“Fill 3D Holes”:需要注意的是,针对不同的实验和图像采集条件,阈值需进行一定的优化,以获得最准确的结果一个理想的阈值应当忠实地捕捉原始图像中线粒体信号的形态,并应避免合并紧密相邻但物理上分离的线粒体,或分裂单个线粒体阈值有全局(Global)阈值和局部(Adaptive)阈值两种类型,如下图所示,一般来讲局部阈值更准确一些Mitochondria Analyzer采用的是局部阈值,局部阈值会计算图像中的每一个像素的阈值,包括均值(Mean)、中值(Median)、中灰度值(MidGrey)和加权平均法(Weighted Mean)四种算法,通常一般来讲Mean和Weighted Mean算法可以获得更加精确的结果:此外,需要对阈值的两个参数进行优化:Block size和C-valueBlock size决定了计算每个像素阈值时所包含的周围像素的范围,其大小一般与想要分析的对象(如线粒体)大小相关C-values提供阈值校正,有助于在最小化背景信号与不正确地将单个线粒体分割成多个小片段之间取得平衡在Threshold Optimize中设定初始Block size和C-value,点击OK,可以自动生成各阈值条件下的阈值处理结果,通过与原始图像进行比较,以确定最佳阈值组合需要注意的是,这里生成的图像栈的前处理和后处理的各项参数是相同的确定最佳参数组合后,点击进入2D Threshold或3D Threshold,对图像进行阈值化处理,以获得二值化图像5. 线粒体形态学分析将上一步获得二值化图像用于线粒体形态和网络分析,Mitochondria Analyzer -> 2D Analysis:对于2D图像参数结果包括用以描述线粒体大小的线粒体面积(area)和周长(perimeter),以及用以描述形态的外形因数(form factor)和纵横比(aspect ratio)描述线粒体网络的参数包括网络分支数(branches)、分支长度(branch lengths)、分支连接(branch junctions)对于3D图像,则通过体积(Volume)和表面积(Surface Area)描述线粒体大小,球形率(Sphericity)描述线粒体形态下图为各项参数的详细计算方式:点击ok输出结果:下图是线粒体荧光图像进行网络分析的具体例子,可知Mitochondria Analyzer的各项参数可以准确的反应不同状态的线粒体网络:扩展:ImageJ网络结构分析神器Ridge (Line) Detection Plugin分析网络,地址:https://imagej.net/Ridge_Detection下载ij_ridge_detect-1.4.0.jar插件后将文件置于plugins文件夹下,重启软件即可Ridge (Line) Detection Plugin分析实例如下:该插件的使用非常简单,有兴趣的小伙伴可自己去了解
MiNA分析线粒体网络MA是一款基于NIH免费开源软件ImageJ开发的线粒体网络分析插件,通过图像处理和线粒体识别,可以方便快捷地实现对2D和3D线粒体网络的精确分析【2】MiNA包含一些可选的预处理步骤将原始线粒体图像转换为二值化图像用于计算线粒体网络参数,下载地址为:https://github.com/ScienceToolkit/MiNA打开链接,点击Clone or download下载MiNA安装MiNA宏,打开FIJI,点击Plugins -> Macros -> Install,选择MiNA-master中src下的MiNA.ijm文件,在Plugins -> Macros即可看见已经安装成功的宏MiNA工作流程如下:MiNA工作流程图对应具体线粒体图片举例:细胞中的线粒体存在两种类型的结构:线粒体网络(Networks)和单独个体(Individuals)下图为线粒体网络结构图解:没有分支连接且分支长度最小的点状对象(单独个体)(左);没有分支连接但分支长度较高的长的单管状个体(中);以及具有多个分支和连接的复杂对象(灰点)下面以一个典型的不同形态的线粒体形态为例进行分析方法介绍,从左到右简化形态依次是点状、管状和线粒体网络:操作步骤:打开FIJI,依照前述方法在Plugins -> Macros中安装NiNA打开示例图片:点击Plugins -> Macros -> MiNA -> Analyze Mitochondrial Morphology将出现以下提示界面:Processing to Apply下有CLAHE,Median Filter和Unsharp Mask三个可选择的预处理选项,默认情况下不选择任何选项参考MiNA工作流程可知预处理有助于骨架结构更接近视觉上看见的拓扑结构,同时这也会引入一定的偏差,因此需要谨慎使用,具体根据分析出的实际效果而定点击OK,开始分析得到结果:NiNA Output可以得到诸多结果:可知单独个体线粒体结构(Individuals)有2个,网络结构(Networks)有1个平均分支长度(Mean Branch Length)为6.529μm,分支长度的中位数(Median Branch Length)为6.936μm长度的标准偏差(Length Standard Deviation)为4.557μm注:关于中位数和平均值,中位数是以统计的最大和最小值中间那个值,比如最小1,最大10中间值是5.5.平均值则是所有测量结果全部加起来去平均比如有5个数,1,3,7,9,10,平均值是6,而中位数是5.5还可得到平均网络结构的大小(Mean Network Size),网络结构大小的中位数(Median NetworkSize),网络结构大小的标准偏差(Network Size Standard Deviation)以及线粒体足(Mitochondrial Footprint)的长度今天半夏给大家分享ImageJ进行线粒体形态学分析就到此为止了,希望对大家有所帮助
感兴趣的小伙伴赶紧去尝试尝试吧参考文献:Chaudhry A, Shi R, Luciani DS. A pipeline for multidimensional confocal analysis of mitochondrial morphology, function, and dynamics in pancreatic β-cells. Am J Physiol Endocrinol Metab. 2020;318(2):E87-E101. doi:10.1152/ajpendo.00457.2019Valente, A.J., et al., A simple ImageJ macro tool for analyzing mitochondrial network morphology in mammalian cell culture. Acta Histochem, 2017. 119(3): p. 315-326.后台私信领取福利—END—





0 评论